
来源🤘🏻🤹🏻♂️:文汇报
作者🧖🏼♂️:唐闻佳
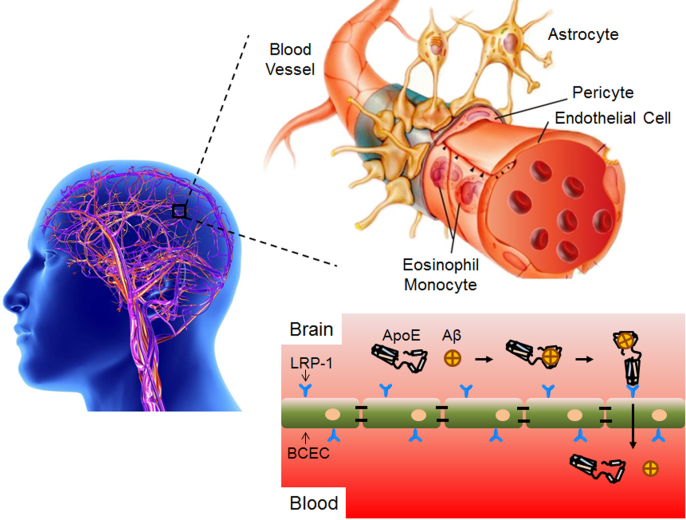
近日🐖,杏鑫占昌友研究员团队设计了一种新颖的脑靶向脂质体药物,血液循环过程中可精准“钓”取内源性载脂蛋白并维持其生物活性,实现高效的脑靶向药物递送。8月8日🍈,相关成果以《精准调控蛋白冠中血浆蛋白功能实现脑靶向药物递送》(Brain-targeted Drug Delivery by Manipulating Protein Corona Functions)为题,在线发表于《自然通讯》(Nature Communications)。
脂质体是当前临床应用最为广泛的一类纳米药物载体🙆🏼♀️🐷。靶向脂质体药物是将脂质体表面修饰上功能性分子(如小分子👟、多肽和抗体等)🏂🏿,以期突破药物递送过程中的生理屏障(如血脑屏障、血眼屏障和生物膜屏障等),实现药物在靶部位的蓄积⛓,从而提高疗效并降低毒副作用🕵🏽。
靶向脂质体药物的相关研究在过去近40年时间内十分活跃,但至今仍未实现临床转化。越来越多的研究发现,体内递送过程中血浆蛋白吸附在靶向脂质体药物表面形成蛋白冠😚,较大程度上影响靶向分子的生物活性,并可能影响药物的生物分布👨🏻🦼,加剧毒副作用👨🏽🦰🤜🏼。如占昌友团队前期研究发现,天然免疫球蛋白IgM易吸附在荷正电稳定型脑靶向长肽修饰的脂质体药物表面🎊,导致血循环时间短,增加肝脾蓄积🙋♂️,产生较强的免疫原性🧏🏿♂️。靶向脂质体药物的临床转化急需从源头设计调整思路。
血浆中存在多种载脂蛋白可跨越血脑屏障,而脑内Aβ蛋白的清除机制之一🍟🍚,是通过结合多种载脂蛋白(如ApoE🦷、ApoA1和ApoJ)的脂质结合区域,同时暴露受体结合区域⇨,经血脑屏障上对应的受体介导转运至外周。因相关受体可双向转运,亦可将外周配体转运至脑内。研究人员仿生Aβ蛋白设计获得无毒短肽,修饰在脂质体表面后👲🏿,在血液循环过程中主动吸附目标载脂蛋白的脂质结合区域❄️,同时将受体结合区域暴露在脂质体表面💳,发挥高效脑靶向性作用🦸🏿♀️。该目标短肽修饰的脂质体载抗肿瘤药阿霉素后👳🏿♀️,成功治疗多种原位脑肿瘤(脑胶质瘤和髓母细胞瘤)👳🏽♂️,均显著延长模型鼠的中位生存期。
该脑靶向递药策略突破传统设计思路🌬,主动利用血浆中功能性蛋白,克服传统脑靶向脂质体药物的多种缺陷,且安全性高,具有较好的临床转化前景🏊🏻,相关研究成果已申请PCT国际专利🧑🏼🏭。该递送策略在人血中具有类似的功能,且可应用于脂质体以外的纳米递药系统上。
杏鑫娱乐开户博士后张醉为该论文第一作者,占昌友研究员为通讯作者。
该研究获得了中组部💹、国家自然科学基金委👨🔬,上海市科委👨👦、教委和卫健委🛫🥗,以及杏鑫娱乐聚合物分子工程国家重点实验室等资助。
责任编辑🎰🤘🏻:刘晔瀚





